
Đang tải...

Đang tải...
Keywords: QqQ, QTRAP, LC-MS/MS, MRM-IDA-EPI, novel pyschoactive subtances, suspect screening, multi-targeted screening, biological samples, whole blood, khối phổ ba lần tứ cực, bẫy ion tuyến tính, phổ ion tăng cường, sàng lọc đa mục tiêu diện rộng.
Giới thiệu: Bài viết này sẽ cung cấp cho bạn đọc một số khái niệm cơ bản liên quan tới khối phổ ba tứ cực (QqQ) và bẫy ion tuyến tính (Linear Ion Trap) cũng như các thông tin cơ bản hệ thống khối phổ lai QqQ/LIT với tên gọi thương mại QTRAP, và trình bày quan điểm của tác giả liên quan tới việc sàng lọc diện rộng và tăng cường định danh tin cậy các chất liên quan trong nền mẫu sinh học. Về tác giả, TS. Lê Sĩ Hưng, tốt nghiệp tiến sĩ tại đại học BOKU Vienna (Cộng hoà Áo) ngành hoá phân tích, đã có trên 10 năm kinh nghiệm làm việc với các thiết bị khối phổ, tập trung vào ứng dụng các kỹ thuật khối phổ trong phân tích các chất chuyển hoá (metabolites) và protein trong các đối tượng mẫu sinh học, ORCID: 0000-0002-0762-3492.
Mở đầu
Hàng năm danh sách các chất trong diện theo dõi và kiểm soát đều được cập nhật, riêng tại Việt Nam theo nghị định số 57/2022/NĐ-CP đã có gần 600 chất với 4 danh mục gồm các ma tuý tuyệt đối cấm sử dụng, sử dụng hạn chế, được sử dụng trong nghiên cứu và kiểm nghiệm, và các tiền chất. Số lượng lớn các chất nằm trong diện kiểm soát và theo dõi này sẽ còn tiếp tục tăng, sự hạn chế của các chất chuẩn mới, hàm lượng thấp của nhiều chất trong nền mẫu sinh học phức tạp trở thành thách thức lớn cho các nhiệm vụ sàng lọc, phát hiện tin cậy các chất này (Negri, n.d.).
So với các phương pháp phân tích miễn dịch, GC-MS là lựa chọn số 1 cho việc phân tích các chất dễ bay hơi hoặc tương đối bền nhiệt trong các phòng thí nghiệm độc học và pháp y. Tuy nhiên để phân tích các chất kém bay hơi (vd: các chất có độ phân cực cao, amino axit, axit hữu cơ, hydrocodone, THCA…) với GC sẽ cần quy trình xử lý mẫu tương đối mất thời gian do cần dẫn xuất hoá (e.g., THCA cần được dẫn xuất hoá với BSTFA), thêm vào đó hiệu suất dẫn xuất hoá và ảnh hưởng của nền mẫu tới phản ứng cũng là các vấn đề cần quan tâm (Bingjie et al., n.d.). Sắc ký lỏng ghép nối khối phổ hai lần (LC-MS/MS) được coi là tiêu chuẩn vàng trong phân tích xác nhận, nhờ khả năng phân tích nhanh với độ nhạy cao cùng khoảng tuyến tính rộng, đồng thời cho nhiều nhóm chất, sử dụng quy trình chuẩn bị mẫu tương đối đơn giản (vd: dilute and shoot, hoặc kết tủa protein). LC-MS/MS nói chung và hệ sắc ký lỏng ghép nối khối phổ ba tứ cực nói riêng (LC-QqQ) đã trở thành một mảnh ghép không thể thiếu trong các phòng thí nghiệm độc học và pháp y. Cung cấp một giải pháp để phân tích nhanh chóng và đơn giản các chất kém bay hơi, không bền nhiệt, từ đó cho phép có những lợi thế đáng kể cho mục đích phân tích sàng lọc nhanh và tin cậy trong lĩnh vực quan tâm (He et al., n.d.).
Nguyên lý hoạt động cơ bản của hệ thống LC-QqQ bao gồm: (1) mẫu sau khi xử lý được bơm lên cột tách của hệ thống sắc ký lỏng hiệu năng cao (HPLC), (2) các chất phân tích sẽ trải qua các tương tác qua lại giữa pha động và pha tĩnh và tách ra khỏi nhau, trước khi tiến vào hệ thống khối phổ, (3) nguồn ion hoá (ionization source) của hệ thống khối phổ sẽ chuyển các chất phân tích từ pha lỏng sang pha khí và tiến hành quá trình ion hoá trước khi các ion chất phân tích tiến vào khu vực chân không bên trong máy, (4) các ion được thu giữ, tái tập trung và di chuyển bên trong thiết bị bằng các hệ thống dẫn, quang học ion (ion guide, ion optics), ion được chọn lọc hoặc truyền qua ở tứ cực đầu tiên (Q1), phân mảnh hoặc truyền qua ở tứ cực thứ 2 (Q2), sau đó chọn lọc, hoặc quét lần lượt ra khỏi tứ cực thứ 3 (Q3), (5) ion lần lượt chạm tới detector và được ghi nhận tín hiệu (cường độ tín hiệu). Các thiết bị QqQ cho phép thu thập thông tin về số khối các ion ở độ phân giải khối unit mass resolution (FWHM ≤ 0,7 Da, tương đương với mass resolution ~ 1.300 ở m/z 922) có thể có trong mẫu, và thông tin về các ion phân mảnh (ion con) tương ứng và đặc trưng của từng chất qua các “MS/MS scan”.
Liên quan tới các phân tích định lượng có mục tiêu, QqQ là lựa chọn hàng đầu với chế độ ghi tín hiệu theo dõi đa phản ứng – MRM (là chế độ ghi tín hiệu trong đó ion mẹ sẽ được chọn lọc ở Q1, phá mảnh ở Q2 và chọn lọc ion con ở Q3) nhờ các ưu điểm về tốc độ phân tích nhanh (thời gian giữa 2 lần ghi tín hiệu của thiết bị – cycle time – nhỏ) và độ nhạy cũng như độ đặc hiệu. Tuy nhiên, với các phân tích định tính cần sử dụng chế độ ghi tín hiệu toàn dải phổ (Full Scan), đây lại không phải là thế mạnh của QqQ do độ nhạy kém và “cycle time” lớn. Để định danh chất 1 cách tin cậy, Schymanski đề xuất 5 cấp độ định danh với độ tin cậy tăng dần, đề xuất này đã được đánh giá và chấp nhận như một guideline bởi nhiều nhóm nghiên cứu khác nhau trên thế giới. Năm cấp độ dịnh danh này bao gồm: Mức 5, độ tin cậy thấp nhất – có số khối chính xác; Mức 4, có công thức phân tử rõ ràng – là khả năng gán được công thức phân tử cho số khối đó; Mức 3, tồn tại cấu trúc có thể có – có các bằng chứng ủng hộ sự tồn tại của các cấu trúc, nhưng không đủ để kết luận được cấu trúc chính xác (ví dụ như trong trường hợp các đồng phân vị trí); Mức 2, có cấu trúc trong thư viện tham chiếu hoặc được xác định bằng các phương pháp khác; Mức 1, độ tin cậy cao nhất – có xác nhận lại với chất chuẩn (Schymanski et al., 2014).
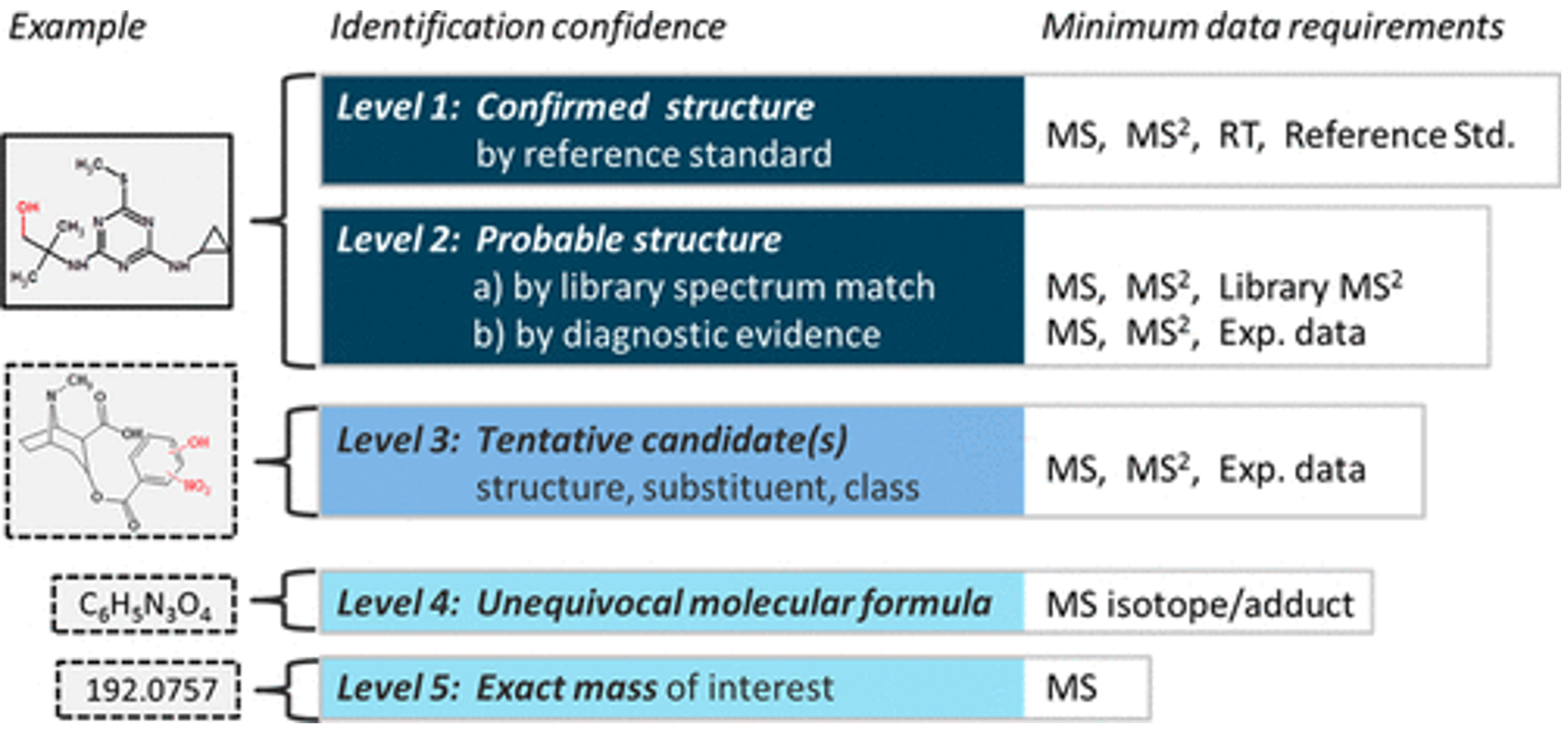
Như vậy theo 5 cấp độ tin cậy này, các thiết bị QqQ thông thường sẽ khó để cung cấp được nhiều thông tin yêu cầu cho việc định danh tin cậy chất. Cho mục đích này, QTOF và các máy khối phổ dựa trên khả năng bẫy ion (Ion Trap) có ưu thế hơn so với QqQ nhờ độ nhạy và tốc độ quét tốt hơn ở chế độ "fulll scan". Các hệ thống QTRAP là giải pháp nâng cấp cho QqQ mà Sciex mang tới cho người sử dụng nhờ sự kết hợp độc đáo giữa tứ cực với bẫy ion tuyến tính (Linear Ion Trap). Hệ thống QTRAP vừa duy trì những ưu điểm về độ nhạy và độ đặc hiệu của hệ QqQ trong phân tích định lượng, vừa hỗ trợ mạnh mẽ cho các yêu cầu phân tích định tính với khả năng ghi được toàn dải phổ ion phân mảnh chất lượng cao có thể được dùng để đối chiếu với thư viện phổ MS/MS.
Hệ thống QTRAP
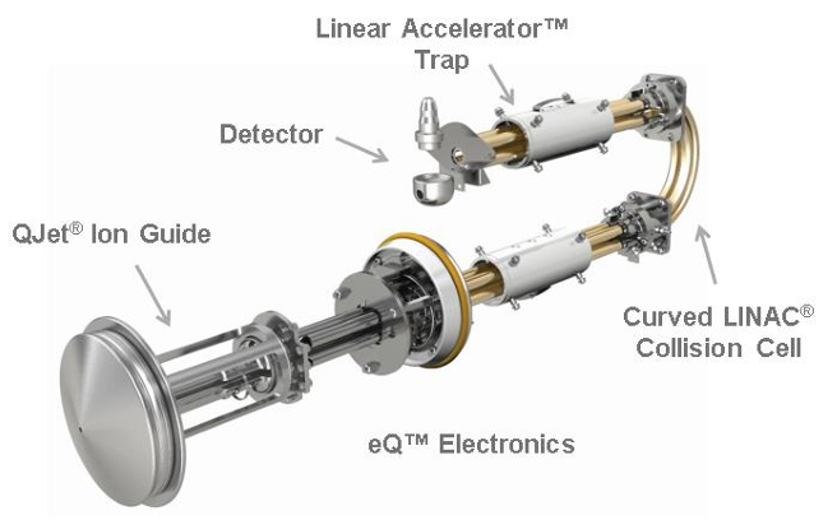
Hình 1. Minh hoạ hệ thống truyền dẫn ion và bẫy ion tuyến tính (Linear AcceleratorTM Trap) trong hệ QTRAP 5500+, trong đó Q3 đã được cải tiến thành một bẫy ion tuyến tính, cho phép bắt giữ và quét ion ra khỏi bẫy với những ưu điểm vượt trội.
QTRAP là công nghệ độc quyền của SCIEX dựa trên hệ thống khối phổ 3 tứ cực. Một hệ thống QTRAP có thể vận hành như một máy khối phổ ba tứ cực thông thường với cùng độ nhạy và đầy đủ các chức năng ghi tín hiệu của QqQ như:
- Ghi phổ theo dõi đa phản ứng (MRM)
- Ghi phổ ion mẹ (Precursor Ion Scan)
- Ghi phổ ion con (Product Ion Scan)
- Ghi phổ neutral/gain loss
- Theo dõi ion chọn lọc ở Q1/Q3 (Selected Ion Monitoring)
- Quét toàn bộ dải phổ (Full scan).
Điểm làm hệ thống QTRAP độc đáo nằm ở chỗ Q3 được thiết kế và có thể vận hành như một bẫy ion tuyến tính (LIT) cung cấp thêm các tính năng quét định tính mạnh mẽ để tăng cường năng suất cũng như sự linh động cho người sử dụng (Hình 1).

Hình 2. Mô tả cấu tạo của bẫy ion tuyến tính trên các hệ QTRAP của Sciex, trong đó 2 điện cực được thêm vào ở phía trước và phía sau của Q3, cho phép đóng mở để bắt giữ và quét các ion ra khỏi bẫy.
Do thiết kế của tứ cực, khi hoạt động ở chế độ quét, cả thế DC và AC áp lên tứ cực sẽ được tăng dần lên với các giá trị phù hợp và cho phép lần lượt các ion có cùng giá trị m/z được đi qua và tới detector. Khi các ion có cùng giái trị m/z đang được ghi tín hiệu, tất cả các ion khác sẽ bị mất đi do va chạm vào các cực và/hoặc vào thành thiết bị. LIT trên hệ QTRAP có thêm các điện cực IQ3 và EXB lần lượt ở phía trước và sau của Q3 cho phép bắt giữ các ion theo 2 phương, gồm: (1) theo phương xuyên tâm của Q3 (radial trapping), (2) bắt giữ ion theo hướng vuông góc với trục xuyên tâm của Q3 (axial trapping) (Hình 2). Quá trình hoạt động của LIT bao gồm 5 bước: (1) lấp đầy bẫy với các ion (fill trap), (2) trước khi quét, ion được làm chậm lại trong 5 ms, (3) quét nhanh các ion nhờ dùng thế AC phụ trợ (auxiliary RF) áp lên các tứ cực gây cộng hưởng các ion có m/z tương ứng và đi ra khỏi bẫy (axial ejection), (4) làm trống bẫy bằng cách giảm thế AC trên các tứ cực của Q3, giảm thế DC trên IQ3 và EXB, (5) lặp lại bước 1.
Như vậy, khi kích hoạt QTRAP, phần lớn các ion sinh ra từ nguồn hoặc từ Q2 đều có thể được bắt giữ và bảo toàn trong LIT. Việc bắt giữ này có 2 ưu điểm vượt trội so với tứ cực thường. Một là do toàn bộ ion được tích luỹ trong bẫy với những khoảng thời gian nhất định (vd: 50 ms) nên sẽ ghi được nhiều tín hiệu hơn, hai là khác với tứ cực thường khi đang quét ion với giá trị m/z này, thì các ion với giá trị m/z khác không bị mất đi mà vẫn được lưu giữ trong LIT. Ngoài khả năng có thể bắt giữ nhiều ion hơn so với bẫy ion 3D (gấp 10 – 20 lần), LIT cho phép tăng cường độ phân giải khối ("mass resolution” lên tới 9.200 ở m/z 922) thông qua việc điều chỉnh tốc độ quét khối và giảm hiệu ứng “space charge” (space charge là hiệu ứng xảy ra khi có quá nhiều ion bị bắt giữ trong một không gian nhỏ, khi đó các ion sẽ xảy ra tương tác lên nhau, ảnh hưởng tới quĩ đạo chuyển động và làm giảm độ phân giải khối), tốc độ quét càng thấp thì độ phân giải phổ thu được càng cao, và ngược lại (“mass resolution” ở m/z 922 có thể đạt tới 9.200 với tốc độ quét 50 Da/giây và chỉ đạt 1.320 ở tốc độ 20.000 Da/giây). Đây chính là 3 ưu điểm cho phép các hệ QTRAP có thể ghi toàn dải phổ với tín hiệu cao ở chế độ ghi phổ MS tăng cường (Enhanced MS – EMS), ghi phổ phân giải tăng cường (Enhanced Resolution – ER), và ghi phổ ion con tăng cường (Enhanced Product Ion – EPI).
Các chế độ quét tăng cường cho phân tích định tính trên QTRAP
Nhờ LIT, các hệ QTRAP có 5 chế độ quét cả dải phổ mở rộng so với QqQ thường, gồm:
- 2 chế độ quét toàn dải phổ EMS và EMC (Enhanced Multiply Charged).
- 1 chế độ quét ER để tăng cường độ phân giải phổ trên khoảng khối hẹp.
- 2 chế độ quét phổ MS/MS là EPI và MS3.
Ngoài ra QTRAP còn có chế độ ghi phổ MRM3 cho độ chọn lọc vượt trội trên nền mẫu phức tạp và chế độ tăng cường độ nhạy nhờ sử dụng Q0 để bắt giữ ion.
EMS: Cung cấp thêm thông tin định danh chất ở mức độ 5 liên quan tới phổ MS và số khối của chất. Trong chế độ đo phổ MS tăng cường, tất cả các ion sinh ra từ nguồn được truyền qua Q1, Q2 và bị bắt giữ toàn bộ ở LIT trong khoảng thời gian xác định (vd: 50 ms). Sau khi LIT được làm đầy, các ion có cùng giá trị m/z lần lượt được cho ra khỏi bẫy và tới detector, trong khi các ion khác vẫn được bảo tồn trong LIT đợi đến lượt ghi tín hiệu của mình. Nhờ toàn bộ ion sinh ra từ nguồn được bắt giữ và bảo toàn trong LIT, phổ EMS sẽ có tín hiệu đầy đủ và vượt trội so với phổ “full scan” ở QqQ thông thường ở cùng điều kiện đo.

Hình 3. So sánh giửa phổ Q1 full scan (ngoài cùng bên trái) và ER (ở giữa) cho cùng chất C21H23NO2FCl, do độ phân giải khối được tăng cường ở ER, các píc đồng vị liên quan của chất có thể được quan sát rõ ràng. Khoảng cách giữa 2 píc đồng vị liền kề là 1 m/z, do đó điện tích của chất được xác định là +1. So sánh kiểu dạng đồng vị của 2 chất, phổ của chất có chứa nguyên tố halogen (ở giữa) và chất chỉ chứa các nguyên tố C, H, N, O (ngoài cùng bên phải). Píc đồng vị thứ 2 của C21H23NO2FCl sẽ thấp hơn píc đồng vị thứ 3 của chất.
ER: Cung cấp thêm thông tin định danh chất ở mức độ 4 liên quan tới kiểu dạng đồng vị và điện tích của chất. Trong chế độ đo tăng cường độ phân giải, Q1 được thiết lập với cửa sổ khối ~6 amu xung quanh giá trị m/z của ion mẹ cần quan tâm, toàn bộ các ion này sẽ được bắt giữ trong LIT và được quét khỏi LIT với tốc độ 250 Da/giây trên một khoảng khối hẹp ~ 30 amu xung quanh m/z của ion mẹ. Các píc khối trong chế độ này sẽ có giá trị FWHM trong khoảng ~0,15 – 0,30 amu, và do đó người dùng có thể thu được thông tin về kiểu dạng đồng vị (isotope pattern) cũng như điện tích (charge state) của chất quan tâm, do đó thu được thêm thông tin về cấu tạo của chất (Hình 3). Như đã biết, nhờ vào khoảng cách giữa các píc đồng vị liền kề trên thang m/z, ta có thể xác định chính xác được điện tích của chất (e.g., khoảng cách = 1 m/z, chất có điện tích = ± 1, khoảng cách = 0,5 m/z, chất có điện tích là ± 2). Thêm vào đó các chất có chứa các nguyên tố khác C, H, N, O như Cl, Br, hoặc S sẽ có kiểu dạng đồng vị rất đặc trưng. Hơn hết, do độ phân giải khối được tăng cường ở chế độ này nên thông tin về số khối của chất cũng sẽ chính xác hơn, hỗ trợ thông tin định danh ở mức độ 5.

Hình 4. So sánh giữa phổ EPI (phổ trên) và phổ ion con của QqQ (PIS) thường (phổ dưới), tín hiệu của phổ EPI cao hơn so phổ PIS ~ 20 lần. Thêm vào đó, các píc của ion con khác (i.e., m/z 99, 110, 138) chỉ có thể được quan sát với phổ EPI. Điều này có thể được giải thích là do LIT cho phép tăng cường tín hiệu của toàn bộ các mảnh sinh ra so với PIS và/hoặc LIT cho phép thu giữ tốt hơn kể cả các mảnh kém nhạy này.

Hình 5. Khi định danh chất chưa biết trên nền mẫu thực phẩm dựa trên thời gian lưu và tỉ lệ ion, kết quả chỉ ra tương đồng cao với metalaxyl (hình bên trái). Tuy nhiên phổ EPI của chất chưa biết tiết lộ chất này chỉ khớp < 24% với phổ MS/MS của metalaxyl trong thư viện. Ghi phổ EPI sẽ hạn chế khả năng dương tính giả và tăng cường độ tin cậy khi định danh chất.
EPI: Cung cấp thêm thông tin định danh chất ở mức độ 3 và 2 liên quan tới phổ phân mảnh và đối chiếu với thư viện phổ. Trong chế độ ghi phổ phân mảnh tăng cường, ion mẹ sẽ được chọn lọc ở Q1 với cửa sổ khối từ 1 – 4 amu, phá mảnh ở Q2, toàn bộ ion con sinh ra sẽ được bắt giữ trong LIT và có thể được quét với 3 mức tốc độ phù hợp với độ phân giải khối yêu cầu. Ở chế độ ghi phổ EPI, năng lượng phá mảnh (collision energy – CE) có thể được thay đổi nhanh chóng ở nhiều mức (e.g., CE từ 20, 35, 50), phổ phân mảnh ở từng mức CE sẽ đều được ghi lại và kết hợp chung trên 1 phổ EPI duy nhất, từ đó cung cấp thông tin phân mảnh toàn diện nhất có thể. EPI cho phép cung cấp phổ MS/MS với độ nhạy cao và chất lượng cao hơn rất nhiều so với chế độ quét phổ ion con trên QqQ thường nhờ khả năng bắt giữ và phân tích toàn bộ các ion con sinh ra bằng LIT (Hình 4). So với việc định danh chất dựa trên tỉ lệ các mảnh con, việc đối chiếu toàn dải phổ MS/MS thu được của chất với thư viện phổ MS/MS (e.g., thư viện NIST17, Sciex forensics…) cho độ tin cậy cao hơn rất nhiều, do nhiều thông tin mảnh con được sử dụng để tham chiếu hơn. Và do vậy, việc ghi được phổ MS/MS toàn dải với độ nhạy cao và chất lượng cao chính là mảnh ghép quan trọng cho phép tăng cường độ tin cậy khi định danh dựa trên đối chiếu với thư viện phổ MS/MS (Hình 5).

Hình 6. So sánh giữa chế độ MRM (343,1 > 299,2) và MRM3 (343,1 > 299,2 > 245 ) cho 100 pg/mL THCA trong: (hình trên) chất chuẩn, (hình dưới) nền mẫu tóc. Với chất chuẩn, MRM3 cho tỉ lệ S/N cao gần gấp đôi so với MRM. Trên nền mẫu tóc, MRM của THCA vẫn bị ảnh hưởng bởi nền mẫu rất nhiều (nhiều píc không xác định, có píc rửa giải rất sát với píc của THCA, tỉ lệ S/N rất tệ). Trong khi ở MRM3, các chất gây ảnh hưởng gần như biến mất hoàn toàn và tỉ lệ S/N cao hơn 1 cách đáng kể.
MS3: Các QqQ thông thường chỉ cho phép người sử dụng thu được thông tin phân mảnh bậc 1 (ion con), LIT trên QTRAP cho phép thu được cả thông tin của phân mảnh bậc 2 (secondary fragment ions). Trong đó, ion mẹ được chọn lọc ở Q1, phá mảnh ở Q2, tất cả các ion con sinh ra được bắt giữ trong LIT. Chỉ một ion con được cô lập trong LIT và được tiếp tục phá mảnh. Các phân mảnh bậc 2 sinh ra sẽ được tiếp tục bắt giữ trong LIT, sau đó lần lượt được quét và ghi tín hiệu. Chế độ MS3 trên QTRAP cho phép người dùng thu được nhiều thông tin về cấu trúc của chất hơn so với QqQ thường. Hơn nữa, LIT cũng cho phép vận hành ở chế độ MRM3 giúp người dùng đạt được độ chọn lọc siêu cao cho các chất cần quan tâm trên nền mẫu phức tạp (Hình 6).
Kết hợp các chế độ tăng cường để định danh tin cậy chất
Các hệ QTRAP cho phép người dùng kết hợp tự động các chế độ ghi tín hiệu cơ bản và tăng cường trong cùng 1 phương pháp đo thông qua việc ghi tín hiệu dựa trên thông tin có trước (Information Dependent Acquisition – IDA) nhằm tận dụng tối đa sức mạnh của LIT trong các phân tích định lượng cũng như hỗ trợ tăng cường độ tin cậy trong phân tích định tính. IDA thường bắt đầu với một “survey scan” (có thể là MS scan hoặc MRM scan), khi tín hiệu thu được từ “survey scan” này phù hợp với các tiêu chí đã thiết lập (IDA criteria) (vd: cường độ tín hiệu, điện tích…) thì sẽ tự động kích hoạt các chế độ ghi phổ khác như EPI, ER, MRM3, MS3…
Trong lĩnh vực độc học pháp y, nhiều nhóm pháp y trên thế giới đã báo cáo về việc sử dụng thành công IDA trên QTRAP kết hợp MRM > EPI > MRM3 nhằm tăng cường độ đặc hiệu và độ nhạy cho phân tích định tính, định lượng nhiều chất cấm (vd: THCA, các chất kích thích liên quan tới amphetamine) trong nền mẫu sinh học phức tạp như mẫu tóc, mẫu máu toàn phần, mẫu nước tiểu và mẫu máu khô (Taylor et al., 2017; Zubaidi et al., 2019).
Trong trường hợp không cần đến độ chọn lọc cao của MRM3 (để rút ngắn “cycle time” của phương pháp, giúp phân tích được nhiều chất hơn), 1 thiết lập IDA phổ thông khác đơn giản hơn là MRM > EPI đã được ứng dụng rộng rãi tại nhiều lab pháp y trên thế giới. Bản chất của phương pháp ghi tín hiệu này gồm 3 bước theo thứ tự lần lượt:
Quét thăm dò với các MRM nhạy và đặc hiệu của các chất quan tâm – “survey MRM scan”.
Nếu tín hiệu thu được từ các MRM này cao hơn ngưỡng đã thiết lập về cường độ tín hiệu (vd: 1.000 cps) thì tự động kích hoạt ghi phổ EPI.
Ghi phổ EPI cho toàn dải phổ ion con (ví dụ: từ 50 – 700 m/z) với thời gian làm đầy bẫy được tự động tối ưu hoá (dynamic trap filling).
Trong đó, thông tin từ "survey MRM scan" không chỉ làm nhiệm vụ thăm dò và kích hoạt ghi phổ EPI, chúng hoàn toàn có thể được sử dụng để định lượng các chất nếu cần thiết, còn phổ EPI chứa thông tin toàn diện về cấu trúc của chất phân tích sẽ được sử dụng để đối chiếu với thư viện phổ MS/MS. Điểm đối chiếu với thư viện đóng vai trò quan trọng trong việc giảm nguy cơ xuất hiện dương tính giả và tăng cường độ tin cậy khi định danh chất.
Nhóm của tác giả Dresen và đồng nghiệp từ khoa độc học và pháp y, Institute of Forensic Medicine, trung tâm y tế đại học Freiburg, Đức đã sử dụng chế độ MRM > EPI trên hệ QTRAP 3200 để sàng lọc có mục tiêu diện rộng (multi targeted screening – MTS) cho >700 chất cấm cùng metabolite liên quan trên nền mẫu sinh học chỉ trong 1 lần bơm mẫu duy nhất (Dresen et al., 2010). Trong phương pháp này, việc ghi tín hiệu bắt đầu với 1 “survey MRM scan” kết hợp với thời gian lưu của của 700 chất liên quan, nếu tín hiệu MRM thu được cao hơn 1.000 cps thì các ion mẹ tương ứng với 2 MRM có tín hiệu cao nhất trong lần từng lần đo sẽ được tự động ghi phổ EPI. Phổ EPI cho các ion này được ghi trong khoảng 50 – 700 amu với thời gian làm đầy LIT là 50 ms, sử dụng tốc độ quét khối 4.000 amu/giây cho các giá trị CE = 35 ± 15 eV. Để đảm bảo thu được thông tin của các chất có cùng thời gian lưu nhiều nhất có thể, ion mẹ đã được ghi phổ EPI 2 lần liên tiếp sẽ được không được ghi phổ EPI trong 15 giây tiếp theo. Nhóm tác giả cũng tận dụng khả năng bắt giữ ion của Q0 trong khi ghi phổ EPI, để tối ưu “cycle time” của phương pháp đo. Trong đó, khi LIT đang ghi phổ EPI thì Q0 sẽ bắt giữ các ion mẹ sinh ra từ nguồn, khi việc ghi phổ EPI vừa kết thúc thì Q0 lập tức thả các ion ra để tiến vào Q1. Các chất nội chuẩn diazepam-d5 và doxepin-d3 được sử dùng làm QC để đánh giá hoạt động của thiết bị, nếu “purity score” của 2 chất này khi đối chiếu phổ EPI thu được với thư viện phổ MS/MS ≤70% thì hệ khối phổ cần được thực hiện bảo dưỡng vệ sinh và/hoặc căn chỉnh lại số khối. “Purity score” phản ảnh 2 điểm thành phần là “fit” và “reverse fit”. Trong đó, “fit” thể hiện sự tương đồng của phổ trong thư viện phổ với phổ EPI của chất chưa biết (trong công thức tính chỉ sử dụng thông tin của các píc xuất hiện trong thư viện). “Revese fit” thể hiện sự tương đồng giữa phổ EPI của chất chưa biết với phổ trong thư viện (trong công thức tính chỉ thông tin của các píc xuất hiện trong phổ của chất chưa biết được sử dụng). Điểm “fit” cao và trong khi “purity score” thấp có nghĩa là phổ chưa biết không tinh khiết nhưng có chứa chất trong thư viện. Điểm “revese fit” cao thể hiện phổ chưa biết có khả năng cao xuất hiện trong thư viện phổ.
Bảng 1. Kết quả phân tích mẫu trắng nước tiểu đã thêm chuẩn với 2 mức nồng độ 10 và 100 ng/mL sau khi chiết lỏng lỏng với chlorobutane ở pH 9 (n = 2). Giá trị trong bảng thể hiện độ tin cậy khi định danh các chất khi tham chiếu phổ EPI thu được với thư viện phổ MS/MS (purity score). Trong đó, điểm tin cậy tối đa là 100, điểm càng cao thì độ tin cậy càng cao. Ghi chú: *, phổ EPI thu được không đủ chất lượng để định danh; **, có tín hiệu MRM nhưng phổ EPI không được kích hoạt. (Dresen et al., 2010)

Cho 16 chất thêm chuẩn vào nền mẫu, hầu hết đều thu được điểm tin cậy cao (purity score ≥70%) khi định danh sử dụng phổ EPI đối chiếu với thư viện phổ MS/MS ở mức nồng độ thấp 10 ng/mL (Bảng 1). Điểm tin cậy của phổ EPI thấp nhất ở mức nồng độ 10 ng/mL của venlafaxine (purity score = 61%) và ở 100 ng/mL của codein (purity score = 64%). Điểm tin cậy trong trường hợp của tilidine và codeine có xu hướng thấp hơn ở nồng độ thêm chuẩn 100 ng/mL khi sử dụng phương pháp chiết lỏng lỏng, tuy nhiên với phương pháp pha loãng mẫu “dilute and shoot” thì “purity score” của tilidine lại có xu hướng không thay đổi (Dresen et al., 2010). Điều này chỉ ra rằng phương pháp chiết lỏng lỏng với chlorobutane có thể gây những ảnh hưởng nhất định lên kết quả đối chiếu với thư viện. Sử dụng phương pháp sàng lọc diện rộng ứng dụng MRM > EPI (MTS), nhóm tác giả báo cáo 1 trường hợp bệnh nhân tử vong do nhiễm độc, kết quả phát hiện 6 chất trong diện theo dõi và kiểm soát trên nền mẫu máu như oxazepam, temazepam… (Hình 7). Nhóm cũng đối chiếu kết quả phát hiện các chất cấm bằng phương pháp MTS trong mẫu máu của 5 đối tượng tình nghi với kết quả thu được từ 1 phương pháp LC-MS/MS đã được thẩm định khác. Kết quả chỉ ra rằng so với phương pháp LC-MS/MS đã thẩm định, phương pháp MTS chỉ có duy nhất 1 trường hợp xuất hiện dương tính giả, là trường hợp của metoprolol của đối tượng số 4 (Bảng 2).

Hình 7. Phổ XIC của 700 cặp MRM thu được khi phân tích sử dụng phương pháp sàng lọc đa mục tiêu tin cậy trong mẫu máu của 1 bệnh nhân tử vong do nhiễm độc, các chất xác định được gồm: paracetamol (1), oxazepam (2), temazepam (3), mirtazapine (4), diphenhydramine (5), methadone (6) và EDDP (7). (Dresen et al., 2010).
Bảng 2. Kết quả phân tích mẫu huyết thanh/ máu sử dụng phương pháp chiết lỏng lỏng. Trong từng trường hợp, 0,5 mL mẫu được chiết, làm khô và thêm dung môi phù hợp tới 0,1 mL trước khi phân tích bằng phương pháp sàng lọc diện rộng hoặc bằng phương pháp LC-MS/MS đã được thẩm định.

Nhóm tác giả từ phòng thí nghiệm Backweston Laboratory Complex, Young's Cross, Ireland cũng sử dụng chế độ MRM > EPI để xác định các chất gây nghiện nhóm opiod, cocaine và amphetamine trong nền mẫu nước tiểu (Dowling et al., 2010). Trong đó, phổ EPI được kích hoạt khi “survey MRM scan” có tín hiệu vượt ngưỡng 500 cps. Phòng thí nghiệm Water and Soild Protection, Bern, Thuỵ Sĩ sử dụng cùng phương pháp ghi tín hiệu để phân tích định lượng và định danh các chất cấm trong mẫu nươc thải của nhiều khu vực ở Châu Âu kết hợp với kĩ thuật bơm mẫu trực tiếp thể tích lớn (large volume direct injection) (Berset et al., n.d.). Liên quan tới việc định danh tin cậy các chất cấm trong mẫu nước thải, các tác giả cũng nhấn mạnh tới nguy cơ thiếu tin cậy khi chỉ sử dụng phương pháp định danh dựa trên tỉ lệ ion (vd: European Guideline 2002/657/EC) để xác nhận các chất trên nền mẫu phức tạp. Nguyên nhân là do tỉ lệ các MRM không phải luôn luôn cố định, ảnh hưởng của nền mẫu có thể ảnh hưởng lên 1 trong 2 MRM, và do đó làm việc định danh dựa trên tỉ lệ ion sẽ không đạt độ tin cậy cao (Hình 8). Thêm vào đó, tỉ lệ đồng vị thường có nguy cơ bị sai ở khoảng cuối của khoảng động học do tình trạng bão hoà của detector, hoặc MRM dùng định tính có thể có tín hiệu quá thấp (kém nhạy) ở khoảng đầu của khoảng động học.

Hình 8. So sánh độ tin cậy của phương pháp đối chiếu thư viện phổ sử dụng phổ EPI và phương pháp tỉ lệ ion (Schreiber, n.d.). Tỉ lệ ion của các chất chuẩn thiabendazole và imazalil lần lượt là 0,63 và 0,37. Tuy nhiên trên nền mẫu thực tế, tỉ lệ này lần lượt là 0,55 và 0,5, “tolerance” lần lượt là 26% và 35% và đều nằm ngoài khoảng hướng dẫn của guideline 2002/657/EC về định danh tin cậy dựa theo tỉ lệ ion. Sử dụng phổ EPI cho các chất này, thì điểm FIT của phổ thu được với thư viện phổ lần lượt là 92,9% và 90,4%, thể hiện độ tin cậy cao cho việc định danh 2 chất trên nhờ kết hợp ghi phổ EPI chất lượng cao và tham chiếu thư viện phổ.
Kết quả từ nhóm nghiên cứu ở Bern sử dụng phổ EPI của các chất để tham chiếu thư viện chỉ ra rằng 9/12 chất quan tâm có thể được định danh tin cậy với mức nồng độ 1 ng/L, trong khi toàn bộ các chất này có thể được định danh tin cậy với mức nồng độ 5 ng/L (sai số thời gian lưu ≤ 5%, điểm đối chiếu thư viện – FIT score ≥ 70%) trên nền mẫu nước thải (Hình 9).

Hình 9. Định danh tin cậy dựa trên tham chiếu phổ EPI thu được với thư viện phổ MS/MS và thời gian lưu của chất. Độ lệch thời gian lưu của các chất theo dõi với thư viện phổ ≤0,1 phút và điểm tham chiếu với thư viện của các chất này đều ≥80%, thể hiện độ tin cậy cao trong việc định danh các chất trên.
Thiết lập MRM > EPI trên Analyst và Sciex OS
Để thiết lập chế độ ghi tín hiệu MRM > EPI trên Analyst, người sử dụng cần thêm thông số kích hoạt EPI (Add IDA Criteria Level) vào phía dưới phương pháp MRM hiện có. Sau khi đã thiết lập IDA Criteria Level, người dùng cần thêm 1 hoặc nhiều “experiment” ở dưới IDA Criteria và chọn EPI ở scan type. Lưu ý, nếu ở IDA Criteria Level, người dùng chọn theo dõi bao nhiêu píc có tín hiệu lớn nhất (e.g., từ 1 tới 3 píc) thì phải thêm từng đó EPI “experiment” vào phía dưới IDA Criteria. Thông số thiết lập tham khảo có thể được tham khảo tại tài liệu “Using Your QTRAP LC/MS/MS System at Full Potential” hoặc quét QR code dưới đây (Hình 10, 11, 12):

Hình 10. Using Your QTRAP LC/MS/MS System at Full Potential

Hình 11. Thêm và thiết lập tiêu chí IDA vào phương pháp MRM cơ bản.

Hình 12. Thêm và thiết lập EPI scan sau khi đã thêm IDA criteria.
Để thiết lập MRM > EPI với Sciex OS, từ MS method workspace, bấm New > IDA (Hình 13), trong mục Survey, chọn MRM. Trong mục IDA Criteria, thiết lập quy trình và thông số cần thiết. Trong mục Dependent, chọn EPI.

Hình 13. Tạo phương pháp IDA trên Sciex OS
Chế độ ghi tín hiệu MRM > EPI hỗ trợ rất mạnh cho các yêu cầu nhắm tới mục đích sàng lọc nhanh, định danh tin cậy và định lượng chất trong 1 lần đo. Tuy nhiên với các phương pháp đo với số lượng mục tiêu sàng lọc lớn, người dùng nên cân nhắc sử dụng thuật toán sMRM kết hợp với phương pháp LC tốt để tối ưu hoá "cycle time" cho phương pháp đo. Giả sử, cho mục đích sàng lọc 100 chất và các chất này rửa giải khỏi cột đều trên toàn bộ gradient tách 10 phút. Như vậy, mỗi phút cần chạy đo MRM > EPI cho 10 chất, mỗi MRM 15 ms, như vậy "cycle time" cho "survey MRM scan" là ~ 300 ms, 1 scan EPI từ 100 - 700 m/z với tốc độ 10.000 Da/giây kèm cả thời gian làm đầy bẫy, làm nguội ion, quét và làm trống bẫy mất ~ 120 ms. Vậy tổng "cycle time" cho 1 phương pháp MRM > EPI (với tối đa ghi 3 phổ EPI / cycle) là ~ 0,7 giây. Với 1 píc sắc kí có động rộng từ 15 - 30 giây, ta sẽ có 20 - 40 điểm ghi dữ liệu (data point) đảm bảo số lượng data poin cần thiết cho 1 píc sắc kí (khuyến cáo từ 12 - 15 điểm / píc). Trong trường hợp khi số lượng mục tiêu sàng lọc quá lớn, để đảm bảo kết quả phân tích định lượng tốt người sử dụng nên cân nhắc tạo thêm 1 phương pháp MRM thông thường chạy cùng với phương pháp MRM > EPI.
Ghi chú ứng dụng - sàng lọc và định dinh 100 chất cấm sử dụng đối chiếu phổ EPI với thư viện phổ MS/MS trong mẫu máu toàn phần ở nồng độ ng/mL sử dụng phương pháp chiết pha rắn với bột kít UTC QuEchERS
Trong ghi chú ứng dụng này, Sciex xin giới thiệu tới người dùng quy trình sàng lọc có mục tiêu diện rộng ổn định, năng suất cao cho 100 chất trong diện theo dõi và kiểm soát sử dụng chiết pha rắn với bộ kít UCT QuEChERS.

Hình 14. TIC của 100 cặp MRM tưng ứng với các chất quan tâm sử dụng trong “survey MRM scan”.
Phương pháp phân tích
Chuẩn bị mẫu: Các chất phân tích mục tiêu được sàng lọc bao gồm: 35 thuốc trầm cảm Rx, 16 benzodiazepine, 17 chất kích thích, 13 opiates, 12 THC/ cannabinoid tổng hợp, 3 cathinones tổng hợp và 2 thuốc trầm cảm OTC. Danh sách toàn bộ các chất phân tích cùng giá trị “cutoff” của nồng độ từng chất (nồng độ “cutoff” là giá trị nồng độ được đề xuất dựa trên dược tính (therapeutic potency) của từng chất) được tổng hợp ở Bảng 3 (Bảng 3). Một chất được coi là dương tính khi nồng độ của chất trong mẫu phải cao hơn giá trị “cutoff” tương ứng nhưng không được thấp hơn LOQ của phương pháp.
Các mẫu máu toàn phần được chiết sử dụng các bộ kít UCT QuEChERS theo quy trình mô tả trong hình 15 (Hình 15) gồm ba bước chính: 1, kết tủa protein và điều chỉnh pH với ACN/NH4OH:95/5 (v/v); 2, dung dịch mẫu thu được lên cột SPE và ly tâm; 3, phần dung dịch mẫu thu được được làm khô và thêm các dung môi thích hợp tới thể tích xác định.

Hình 15. Quy trình chiết pha rắn cho mẫu máu toàn phần sử dụng spin SPE UCT QuEChERS gồm 12 bước (tổng thời gian cbi mẫu 30 – 40 phút).
HPLC: Các chất phân tích được tách trên hệ thống Shimadzu Prominence UFLC sử dụng cột Phenomenex Kinetex® phenyl-hexyl (50 x 4,6mm, 2,6 µm, 00B-4495-E0). Các pha động gồm: A, ammonium formate (NH4FA) và formic axít (FA) trong nước; B, FA trong MeOH. Tổng thời gian phân tích là 12 phút, thể tích mẫu bơm lên cột là 5 μL .
.
MS/MS: Các chất được phân tích trên hệ SCIEX QTRAP® 5500 với nguồn ion hoá ESI Turbo V™. Chế độ ghi tín MRM > EPI được sử dụng cho phương pháp sàng lọc có mục tiêu diện rộng này. Trong đó, các MRM có độ chọn lọc và độ nhạy cao được sử dụng trong “survey MRM scan”, các tiêu chí IDA được thiết lập để tự động kích hoạt việc ghi phổ ion con tăng cường (EPI).
Xử lý số liệu: Kết quả thu được từ MRM của các chất phân tích được sử dụng để phân tích định lượng các chất, phổ EPI được sử dụng để tham chiếu thư viện phổ MS/MS được sử dụng để xác nhận các chất phát hiện bằng phần mềm MultiQuant™ Software và Analyst® Software Reporter.
Bảng 3. Danh sách các chất trong diện theo dõi và kiểm soát và giá trị “cutoff” tương ứng bao gồm trong phương pháp sàng lọc diện rộng sử dụng chế độ MRM > EPI.

Định danh tin cậy chất sử dụng phổ EPI tham chiếu với thư viện phổ MS/MS
Phổ EPI (phổ ion con tăng cường ghi trên toàn dải phổ với chất lượng cao) thu được chứa thông tin toàn diện về cấu trúc đặc thù của phân tử chất phân tích quan tâm được sử dụng để đối chiếu với thư viện phổ MS/MS nhằm tăng cường độ tin cậy khi định danh. Cách tiếp cận này cung cấp khả năng xác nhận chính xác một chất và giảm thiểu đáng kể nguy cơ dương tính giả trong các mẫu chưa biết. Sử dụng phương pháp sàng lọc toàn diện này, >100 chất quan tâm có thể được phát hiện dễ dàng và định danh trong 12 phút phân tích. Hình 16 thể hiện phổ XIC, phổ EPI thu được của chất và phổ MS/MS trong thư viện của (A) morphine và (B) amphetamine (Hình 16). Cho cả 2 chất điểm “purity score”, “fit” và “revese fit” đều cao (>90%) thể hiện độ tin cậy cao khi định danh 2 chất này sử dụng thư viện phổ MS/MS.

Hình 16. Đối chiến thư viện phổ MS/MS tự động cho việc định danh tin cậy chất (A) morphine và (B) amphetamine trong một mẫu bắt giữ được: a) phổ XIC cho phép đánh giá tổng quan chất lượng píc của chất thông qua cường độ tín hiệu, thời gian lưu, hình dạng píc, b) phổ EPI của chất chưa biết, c) phổ MS/MS trong thư viện. Điểm purity của morphone là 93,7% và 94,5% của amphetamine thể hiện độ tin cậy cao khi xác định 2 chất này.
Sử dụng chế độ MRM > EPI, thông tin thu được từ “survey MRM scan” không chỉ được sử dụng để kích hoạt việc ghi phổ EPI, mà còn cho phép định lượng chất hiệu quả nhờ sử dụng các MRM nhạy và đặc hiệu. Phương pháp sàng lọc có mục tiêu diện rộng có độ nhạy rất tốt, có thể dễ dàng phát hiện các ion ở mức nồng độ LOD = 0,5 ng/mL.
Kết luận
Các hệ thống QTRAP từ Sciex, cho phép người dùng có thể thu được đồng thời thông tin phân tích định lượng và thông tin định danh tin cậy mà không phải hy sinh hiệu suất phân tích, độ nhạy và độ đặc hiệu của phương pháp đo. Phương pháp IDA với chế độ ghi tín hiệu MRM > EPI hỗ trợ rất mạnh cho các yêu cầu phân tích và sàng lọc có mục tiêu diện rộng. Trong đó, thông tin quét thăm dò từ “survey MRM scan” vừa có thể được sử dụng để tiến hành định lượng chất, vừa được sử dụng để kích hoạt phổ ion con tăng cường (EPI) để tăng khả năng định danh tin cậy, giảm thiểu nguy cơ xuất hiện dương tính giả so với phương pháp định danh sử dụng tỉ lệ ion do sử dụng toàn bộ thông tin các phân mảnh đặc thù của chất khi tham chiếu với thư viện phổ MS/MS.
Tài liệu tham khảo
Berset, J.-D., Scherer, M., Schreiber, A., & Winkler, P. (n.d.). Quantitation and Identification of Legal and Illicit Drugs in Wastewater in the low ng/L Range using LargeVolume Injection and LC-MS/MS.
Bingjie, L., Chongjun, Y., Yaping, X., Haiyan, C., Lijun, L., & Lihai, G. (n.d.). Rapid DUID screening of 17 drugs of abuse in plasma and saliva Using the SCIEX Triple QuadTM 3500 LC-MS/MS System with an ExionLCTM AD System.
Dowling, G., Regan, L., Tierney, J., & Nangle, M. (2010). A hybrid liquid chromatography–mass spectrometry strategy in a forensic laboratory for opioid, cocaine and amphetamine classes in human urine using a hybrid linear ion trap-triple quadrupole mass spectrometer. Journal of Chromatography A, 1217(44), 6857–6866. https://doi.org/10.1016/J.CHROMA.2010.08.043
Dresen, S., Ferreirós, N., Gnann, H., Zimmermann, R., & Weinmann, W. (2010). Detection and identification of 700 drugs by multi-target screening with a 3200 Q TRAP® LC-MS/MS system and library searching. Analytical and Bioanalytical Chemistry, 396(7), 2425–2434. https://doi.org/10.1007/s00216-010-3485-2
He, X., Burrows, C., Noestheden, M., Jarvis, M., Taylor, A., & Wang, A. (n.d.). Rapid and Sensitive Analysis of a 93-Compound Forensic Panel in Urine using the QTRAP®/Triple QuadTM 4500 LC-MS/MS System.
Negri, P. (n.d.). Expanding NPS screening capabilities in the forensic toxicology laboratory Screen for over 900 compounds using the vMethod application on the SCIEX X500R QTOF system. Retrieved March 5, 2024, from https://sciex.com/tech-notes/forensic/toxicology/expanding-nps-screening-capabilities-in-the-forensic-toxicology-
Schreiber, A. (n.d.). Higher Confidence in Identification with QTRAP ® LC/MS/MS Systems when Screening and Quantifying Pesticides in Fruit and Vegetable Samples.
Schymanski, E. L., Jeon, J., Gulde, R., Fenner, K., Ruff, M., Singer, H. P., & Hollender, J. (2014). Identifying Small Molecules via High Resolution Mass Spectrometry: Communicating Confidence. Environmental Science & Technology, 48(4), 2097–2098. https://doi.org/10.1021/es5002105
Taylor, A., He, X., Wang, A., & Morla, A. (2017). Quantification of 11-nor-9-carboxy-THC and panel of 22 drugs in hair using a hybrid triple quadrupole linear ion trap mass spectrometer (QTRAP). Toxicologie Analytique et Clinique, 29(2), S68–S69. https://doi.org/10.1016/J.TOXAC.2017.03.101
Zubaidi, F. A., Choo, Y. M., Tan, G. H., Hamid, H. A., & Choy, Y. K. (2019). A Novel Liquid Chromatography Tandem Mass Spectrometry Technique using Multi-Period-Multi-Experiment of MRM-EPI-MRM3 with Library Matching for Simultaneous Determination of Amphetamine Type Stimulants Related Drugs in Whole Blood, Urine and Dried Blood Stain (DBS)—Application to Forensic Toxicology Cases in Malaysia. Journal of Analytical Toxicology, 43(7), 528–535. https://doi.org/10.1093/JAT/BKZ017
