Đang tải...

Đang tải...
Hệ thống quan sát tế bào sống thường gồm có một kính hiển vi soi ngược, có thể trang bị thêm camera để chụp ảnh và quay video. Để cung cấp độ tương phản và độ phân giải cần thiết để phát hiện các tính năng trong hình ảnh tế bào sống, kính hiển vi phải có khả năng thu thập đủ ánh sáng từ mẫu vật để tạo ra nhiễu có thể diễn giải theo cách thông tin. Ưu điểm của kính hiển vi soi ngược so với kính hiển vi soi thuận là không gian chứa mẫu lớn, có thể đặt cả bình nuôi cấy, đĩa giếng, đĩa Petri hay lam kính và quan sát mẫu ở dưới đáy của vật chứa. Khoảng cách giữa tụ quang và bàn mẫu khá lớn, cho phép người sử dụng có thể dễ dàng thao tác trên mẫu vật. Một số hệ thống cao cấp có thể được trang bị bàn mẫu điều khiển bằng mortor, có thể tự động điều chỉnh tiêu cự trong suốt quá trình quan sát sự chuyển động của mẫu. Ngoài ra, việc duy trì các tế bào sống trong điều kiện khỏe mạnh trong thời gian dài trên giai đoạn kính hiển vi đòi hỏi phải kiểm soát chặt chẽ nhiều biến môi trường. Do đó, có thể trang bị thêm cho kính hiển vi một hệ thống buồng kính điều chỉnh nhiệt độ, C02, độ ẩm,...
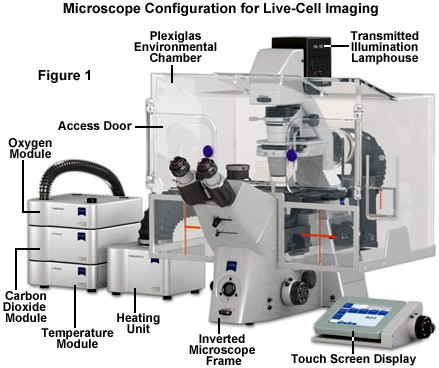
Hình 1: Hệ thống kính hiển vi và buồng nuôi cấy tế bào sống ZEISS Axio Observer
Trong kính hiển vi trường sáng (bao gồm cả các kỹ thuật tăng cường độ tương phản DIC, HMC và tương phản pha), các nguồn sáng bao gồm đèn halogen truyền thống và đèn LED. Các nguồn LED được giới thiệu gần đây cung cấp phổ cường độ ổn định, tuổi thọ cao và tạo ra ít nhiệt hơn so với đèn sợi đốt, nên đang được sử dụng ngày càng phổ biến hơn so với đèn halogen. Nhiệt lượng phát ra thấp của đèn LED giúp bảo toàn mẫu trong thời gian dài.
Phần lớn các mẫu sinh học sống, bao gồm cả tế bào động vật và thực vật, vi sinh thường trong suốt, cho ánh sáng đi qua và có rất ít đặc điểm màu sắc hoặc độ khác biệt trong chỉ số khúc xạ để có thể tạo ra độ tương phản cao. Do đó, hình ảnh các hệ thống kính hiển vi chuyên cho quan sát tế bào sống phải được tăng cường độ tương phản bằng các kỹ thuật quang học khác nhau, chẳng hạn như tương phản DIC, phản pha, Hoffman (HMC) và huỳnh quang.
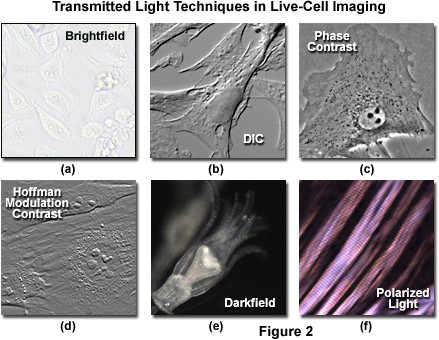
Hình 2: các kỹ thuật hiển vi cơ bản để quan sát tế bào sống
Kỹ thuật DIC (hình 2b) sử dụng lăng kính Nomarski để phóng đại sự sự khác biệt phút về độ dốc của mẫu vật và chỉ số khúc xạ. Chẳng hạn, hai lớp lipid tạo ra độ tương phản tuyệt vời trong DIC vì sự khác biệt về chỉ số khúc xạ giữa pha nước và lipid của tế bào. Ngoài ra, ranh giới giữa các bào quan trong tế bào thực vật và động vật có vú tương đối phẳng, bao gồm màng sinh chất, nhân, không bào, ty thể thường tạo ra độ dốc đáng kể, dễ dàng được phân biệt bằng DIC. Kỹ thuật này cũng thuận lợi cho việc chụp ảnh các tế bào có độ dày khá lớn để cho ảnh giả nổi 3D của vật, ví dụ như phôi động vật (ứng dụng nhiều trong thụ tinh nhân tạo). Hạn chế của kỹ thuật này là chỉ quan sát được các mẫu vật chứa trong vật liệu bằng thủy tinh.
Kỹ thuật tương phản pha (hình 2c) là kỹ thuật phổ biến, sử dụng một cơ chế quang học để biến các biến đổi phút trong pha thành các thay đổi biên độ, có thể được hình dung như sự khác biệt về độ tương phản hình ảnh. Kính hiển vi phải được trang bị một tụ quang chuyên dụng với một bộ vật kính chứa các vòng pha tương ứng. Tương phản pha là một phương pháp tuyệt vời để tăng độ tương phản khi xem hoặc chụp ảnh các tế bào sống trong nuôi cấy, nhưng thường dẫn đến các quầng sáng quá mức xung quanh các đường viền của các tế bào. Những quầng sáng này thường làm giảm khả năng hiển thị của các chi tiết biên. Kỹ thuật này không hữu ích đối với các mẫu vật dày (như phần mô thực vật và động vật và phôi).
Tương phản Hoffman (hình 2d) là một kỹ thuật chiếu sáng xiên giúp tăng cường độ tương phản trong các tế bào sống và mô bằng cách phát hiện độ dốc pha. Tương phản Hoffman không bị cản trở bởi việc sử dụng vật liệu lưỡng chiết (như đĩa Petri bằng nhựa) trong con đường quang học, vì vậy kỹ thuật này hữu ích hơn trong việc kiểm tra mẫu vật trong các vật chứa được chế tạo bằng vật liệu polymer.
Kính hiển vi trường tối (hình 2e), mặc dù được áp dụng rộng rãi để chụp ảnh các mẫu vật trong suốt trong suốt thế kỷ mười chín và hai mươi, đã bị giới hạn sử dụng. Trong kỹ thuật này, mẫu vật sau đó có thể được hình dung như một vật thể sáng trên nền đen. Tuy nhiên thực tế là bụi và mảnh vụn trong buồng chụp ảnh cũng đóng góp đáng kể vào hình ảnh thu được. Hơn nữa, các tế bào bám dính mỏng thường phải chịu tín hiệu rất mờ, trong khi các mô thực vật và động vật dày chuyển hướng quá nhiều ánh sáng vào vật kính, làm giảm hiệu quả của kỹ thuật.
Kính hiển vi phân cực (Hình 2f) được tiến hành bằng cách xen mẫu vật giữa các yếu tố phân cực chéo. Một số cấu trúc bên trong tế bào có đặc tính lưỡng chiết, như thành tế bào thực vật, hạt tinh bột và trục chính phân bào, cũng như mô cơ. Ví dụ mô cơ thỏ được minh họa trong Hình 2 (f) là một ví dụ về kính hiển vi ánh sáng phân cực được áp dụng để quan sát mô sống. Lưu ý rằng kỹ thuật này bị hạn chế bởi sự xuất hiện hiếm gặp của các cấu trúc lưỡng chiết trong các tế bào và mô sống, và vẫn chưa được khám phá đầy đủ.
Kính hiển vi huỳnh quang trong quan sát tế bào sống
Trong các ứng dụng hình ảnh tế bào sống, kính hiển vi huỳnh quang trường rộng rất hữu ích cho việc quan sát động lực học của các tế bào được phát triển trong các buồng môi trường chuyên biệt. Trong cấu hình cơ bản nhất, kính hiển vi đảo ngược được trang bị nguồn sáng huỳnh quang được ghép với hệ thống camera và bộ lọc huỳnh quang thích hợp. Các nguồn sáng bao gồm đèn thủy ngân, xenon, đèn halogen và đèn LED. Hiện nay các Fluorophores tổng hợp rất đa dạng, có phổ phát xạ bao phủ các vùng cực tím, vùng nhìn thấy và cận hồng ngoại. Việc áp dụng các protein huỳnh quang được mã hóa di truyền đã mở rộng đáng kể khả năng chụp ảnh tế bào sống trong kính hiển vi huỳnh quang bằng cách cho phép các nhà điều tra nhắm vào mục tiêu cụ thể với độ chính xác cao.
Hạn chế lớn đối với kính hiển vi huỳnh quang cơ bản là huỳnh quang phát sinh từ các vùng cách xa mặt phẳng tiêu cự, cũng như tín hiệu nền cao, tạo ra ánh sáng không hữu ích, thường che khuất các cấu trúc quan tâm. Huỳnh quang cũng có thể được kết hợp với các phương pháp tương phản khác như DIC, phản pha để có thể mang lại nhiều thông tin hơn cho hình ảnh.
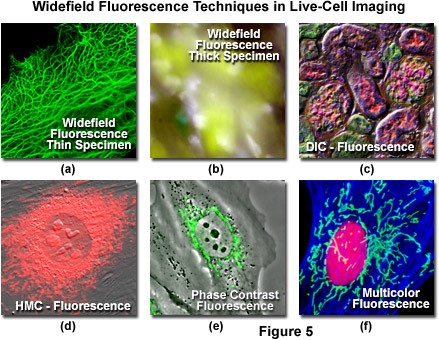
Hình 3: ảnh huỳnh quang kết hợp với các pp tương phản khác
Kính hiển vi đồng tiêu quét laser (LSM) cung cấp một số lợi thế so với kính hiển vi huỳnh quang thông thường, bao gồm độ sâu trường có thể kiểm soát, loại bỏ hình ảnh ngoài tiêu cự và khả năng thu thập các phần quang học từ các mẫu vật dày. Những tia laser chiếu tập trung vào tưng điểm của mẫu vật, do đó có thể quan sát được các chi tiết rất nhỏ trong tế bào như protein, actin, nhiễm sắc thể,… một cách rõ nét. Chìa khóa của phương pháp tiếp cận tiêu điểm là sử dụng lỗ hội tụ (pinhole) để loại bỏ ánh sáng ngoài tiêu cự. Ưu điểm bổ sung của kính hiển vi đồng tiêu quét laser bao gồm khả năng điều chỉnh độ phóng đại điện tử bằng cách thay đổi khu vực được quét bằng laser mà không phải thay đổi vật kính. Tính năng này được gọi là hệ số thu phóng và thường được sử dụng để điều chỉnh độ phân giải không gian hình ảnh bằng cách thay đổi thời gian lấy mẫu laser quét. LSM thường được ứng dụng để quan sát sâu vào các chi tiết và các quá trình bên trong tế bào sống, có thể quan sát các mẫu dày mà kính hiển vi huỳnh quang thông thường không làm được, nghiên cứu động học của tế bào, các quá trinhg FRAP, FRET…
Nhược điểm chính của kính hiển vi đồng tiêu quét laser thông thường đối với các tế bào và mô hình ảnh là hình ảnh được thu thập bằng cách quét raster mẫu vật, tương đối chậm và thường cần vài giây hoặc lâu hơn trên mỗi hình ảnh. Ngoài ra còn có một mức độ rủi ro cao từ việc chiếu xạ mẫu vật bằng ánh sáng laser mạnh có thể tạo ra độc tính quang trong tế bào sống.
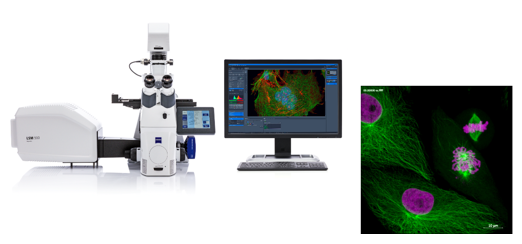
Hình 4: Hệ thống kính hiển vi laser quét đồng tiêu ZEISS LSM 900